The final launch of the Allmultimedia.org will take place on February 27, 2026
(shortly after the 2026 Winter Olympics).
Atomový orbital
Z Multimediaexpo.cz
Atomový orbital je kvantový stav elektronu v elektronovém oblaku okolo atomu. Tento pojem nelze vysvětlit pomocí klasické představy o struktuře atomu, kdy okolo jádra obíhají elektrony podobně jako planety okolo slunce. Elektron, jako každá elementární částice, vykazuje vlastnosti, které odpovídají jak částicím, tak vlnění (dualita částice a vlnění). V důsledku Heisenbergova principu neurčitosti nelze přesně stanovit polohu elektronu v atomu (v daném časovém okamžiku), proto musíme k popisu využít pravděpodobnost. Atomový orbital je popsán vlnovou funkcí elektronu v elektrickém poli nabitého jádra, která je řešením Schrödingerovy rovnice. Orbital ohraničuje oblast, kde je nejvyšší pravděpodobnost výskytu daného elektronu.
Obsah |
Značení orbitalů
Orbitaly se označují podle obecného vzorce
- X typy
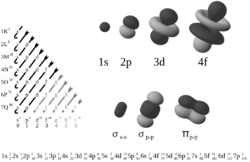
kde X odpovídá energii orbitalu (hlavní kvantové číslo elektronu n). Typ orbitalu se značí malým písmenem a popisuje tvar orbitalu, odpovídá momentu hybnosti (vedlejšímu kvantovému číslu l) a y je počet elektronů v orbitalu-každý orbital má 2 elektrony, přičemž se tyto elektrony liší svým spinem. Orbital "s" není degenerovaný, a proto obsahuje 2 elektrony (s2), orbital "p" je 3x degenerovaný, a proto obsahuje 3x2 = 6 elektronů (p6), orbital "d" je 5x degenerovaný a obsahuje 5x2 = 10 elektronů (d10) a nakonec orbital "f" je 7x degenerovaný a obsahuje tudíž 7x2 = 14 elektronů (f14). Např. jediný obsazený orbital atomu helia v základním stavu se označuje 1s² – obsahuje 2 elektrony na nejnižší energetické úrovni (n=1) a jejich moment hybnosti je l=0. Hypoteticky existují i další typy orbitalů než je s, p, d, f.
Typy orbitalů s, p, d
s px, py, pz dxy, dxz, dyz, dx2-y2, dz2 Orbitaly "f" jsou mnohem složitější (mají více nodálních ploch a je jich celkem 7 typů).
Nodální plocha
Každý orbital, kromě nejmenšího 1s, obsahuje plochy, kde pravděpodobnost výskytu elektronu dosahuje minima. Tato plocha se nazývá nodální plocha. Jejich počet je pro orbitaly typu ns a np dán vztahem n-1.
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |