Foreground plně podporuje – RWD, HTML 5.0, Super Galerii a YouTube 2.0 !
Archea
Z Multimediaexpo.cz
Archea (Archaea, z řec. ἀρχαῖα, archaia — starobylý[1]), jednotné číslo archeon, dříve též archebakterie (Archaebacteria), je rozsáhlá skupina (doména) prokaryotických jednobuněčných organismů, jejíž nezávislost na ostatních doménách života (bakterie a eukaryota) byla zjištěna teprve roku 1977.
Velikost buněk se u různých zástupců značně liší, obvykle se pohybuje od 0,1 do 15 mikrometrů. Od bakterií a eukaryot je odlišuje stavba jejich cytoplazmatické membrány, buněčné stěny, genom a některé metabolické pochody. Rozmnožují se binárním dělením.
Na Zemi se archea objevila již před 3,5 miliardami let. Ačkoliv se mnohá archea vyskytují v pestrém spektru různých prostředí, dnes jsou známa především jako extrémofilní organismy. Vyhledávají extrémní stanoviště s vysokou teplotou, extrémním pH či vysokým obsahem solí. Hrají významnou roli v koloběhu prvků, zejména uhlíku, dusíku a síry. Některá archea či jejich enzymy našly užití i v technologiích a průmyslu.
Obsah |
Klasifikace
Počátky výzkumu
Na začátku dvacátého století byla všechna prokaryota (dnes archea a bakterie) považována na základě biochemických, morfologických a fyziologických znaků za stejnorodou skupinu organismů. Vědce k tomu vedlo například složení jejich buněčné stěny, tvar buňky a druh přijímané potravy.[2] Ke špatné úrovni poznání archeí přispívala i skutečnost, že je archea těžké kultivovat: vyžadují specifickou teplotu, obsah solí a množství kyslíku.[3] V roce 1965 byl navržen nový typ klasifikace,[4] který spočíval ve zjišťování genových sekvencí nukleových kyselin daného organismu. Na základě genetického materiálu se totiž dá poznat, která prokaryota jsou si příbuzná více a která méně. Tento tzv. fylogenetický typ systematiky se užívá dodnes.

(rozměry vřídla: asi 75×91 m, letecká fotografie)
Carl Woese a George E. Fox v roce 1977 na základě sekvenace genů kódujících rRNA (ribozomální RNA) vytvořili termín archebakterie pro popis organismů, které jsou fylogeneticky nezávislé na pravých eubakteriích (Eubacteria).[5] Dnes se pro archebakterie spíše používá taxon Archaea a pro tehdejší eubakterie se razí jednoduše termín bakterie, čímž se zdůrazňuje vzájemná nezávislost těchto skupin organismů. Tři skupiny života, tedy archea, bakterie a eukaryota, se často označují jako domény.[1] Zpočátku se do nové domény řadila pouze methanogenní prokaryota, protože se předpokládalo, že archea žijí jen v extrémních podmínkách (tzv. extrémofilové), jako jsou například horká vřídla či slaná jezera. Na konci dvacátého století se však zjistilo, že se archea běžně vyskytují i na mnohem méně extrémních stanovištích, jako je například půda či mořská voda.[6] Archea zde byla objevena na základě sběru vzorků nukleových kyselin z prostředí. Ty byly pak namnoženy pomocí polymerázové řetězové reakce a identifikovány, většinu archeí totiž nelze kultivovat v laboratoři.[7][8]
Současný přístup

Klasifikace archeí je i dnes neustále v pohybu. Současné systémy se snaží seskupovat organismy na základě jejich skutečné příbuznosti.[9] Velkou roli v systematice hrají sekvence ribozomální RNA, díky nimž lze příbuzenské vztahy odhalit.[10] Většina z těch nejznámějších archeí se dnes řadí do dvou kmenů, Euryarchaeota a Crenarchaeota. Přesto existují i další kmeny, například druh Nanoarchaeum equitans, objevený v roce 2003, je klasifikován v samostatném kmeni Nanoarchaeota.[11] Pro hrstku neobvyklých termofilních archeí se zase zavedl kmen Korarchaeota, pravděpodobně příbuzný s kmenem Crenarchaeota.[12][13] Podobně byl pro druhy Nitrosopumilus maritimus, Cenarchaeum symbiosum a příbuzná mezofilní archaea zaveden kmen Thaumarchaeota.[14] Skupina ARMAN (Archaeal Richmond Mine Acidophilic Nanoorganisms), která byla objevena roku 2006, má ještě nevyjasněnou systematiku.[15] Klasifikace archeí do jednotlivých druhů dle binomického názvosloví je problematická. Zatímco např. živočišné druhy jsou snadno definovatelné na základě schopnosti se rozmnožovat pouze s příslušníky svého druhu,[16] u archeí se nevyskytuje pohlavní rozmnožování a jednotlivé buňky si mezi sebou často genetický materiál vyměňují horizontálně. V rámci výzkumu rodu Ferroplasma bylo navrhnuto, aby se druh definoval jako skupina jedinců, kteří mají velmi podobné genomy a zřídkakdy u nich dochází k horizontální výměně genetické informace s jinými druhy.[17] Podle jiných studií však probíhá značná výměna DNA i mezi jednotlivými druhy.[18] Lidské znalosti o diverzitě archeí jsou dnes ještě kusé, a tak nelze s jistotou odhadnout počet jejich „druhů“.[10] Odhady hovoří až o 18–23 archeálních kmenech, z nich je však dosud člověk schopen kultivovat jen osm kmenů. Velká většina z hypotetických kmenů je známa pouze z jedné rRNA sekvence, což napovídá, že diverzita archeí je ještě z velké části zahalená tajemstvím.[19]
Vznik a vývoj

Archea jsou prastará forma života a stáří některých fosílií se odhaduje až na 3,5 miliardy let.[20] Určité zbytky lipidů, které pravděpodobně patřily archeálnímu či eukaryotickému organismu, se datují do doby před 2,7 miliardami let,[21] jiné nálezy podobného typu z Grónska jsou staré údajně až 3,8 miliardy let.[22] Archea tak mohou být nejstarší linií života na Zemi.[23] Zatímco Woese se přikláněl k tomu, že archea, bakterie a eukaryota reprezentují každý samostatnou větev života,[24][25] někteří vědci se domnívají, že archea a eukaryota vznikla jen z jedné skupiny bakterií.[26] Vztah mezi doménami archea a eukaryota není zcela vyjasněn. Na základě některých podobností jsou mnohdy tyto dvě skupiny dávány do souvislosti. Zdá se, že se dnešní eukaryota se vyvinula z archeí.[27][28] Také proto se dnes z hlediska přirozené klasifikace kritizuje termín prokaryota, seskupující archea a bakterie do jedné vývojové skupiny.[29] Naopak byl vytvořen taxon Neomura, který klasifikuje společně archea a eukaryota, a znázorňuje tak jejich evoluční blízkost. U některých bakterií byly objeveny geny podobné archeálním genům, což situaci znepřehledňuje, vysvětluje se to však horizontálním přenosem genetické informace.[30]
Stavba
Velikost a tvar buněk
Velikost individuální archeální buňky se pohybuje od 0,1 μm do více než 15 μm v průměru a existují buňky velmi odlišných tvarů – kokovité, tyčinkovité, spirálovité i ploché.[31] Rod Sulfolobus se vyznačuje atypickými nepravidelnými buňkami s množstvím laloků, Thermofilum má buňky jehlovitého tvaru, Thermoproteus a Pyrobaculum mají tvar téměř obdélníkovitý.[32] Haloquadratum je dokonce plochý a čtvercový.[33] Na vzniku těchto neobvyklých tvarů se pravděpodobně podílí buněčná stěna a cytoskelet, který je u archeí ještě málo prozkoumaný.[34] Některá archea tvoří agregáty či vlákna skládající se z více buněk. Tato uskupení mohou dosahovat délky až 200 μm[31] a mohou být důležitými členy kompaktních mikrobiálních společenstev (biofilm).[35] Zajímavé mnohobuněčné kolonie vytvářejí archea rodu Pyrodictium, jejichž buňky vypadají jako dlouhé tenké trubičky, z nichž vzniká jediná hustá kolonie.[36] Extrémním případem agregace však nesporně je Thermococcus coalescens, u níž dochází až k úplné fúzi buněk za vzniku jediné buňky značné velikosti.[37]
Struktury na povrchu buněk
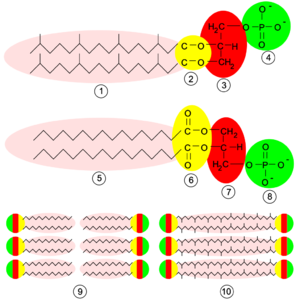
Struktury na povrchu buněk archeí mohou připomínat bakterie. Také archea totiž mají cytoplazmatickou membránu a kolem ní buněčnou stěnu.[38] Strukturálně se podobají grampozitivním bakteriím, jelikož mají jedinou plazmatickou membránu i buněčnou stěnu a postrádají periplazmatický prostor. Výjimkou z pravidla je archeon rodu Ignicoccus, který periplazmatický prostor má, a ten navíc obsahuje membránové váčky (vezikuly) a je uzavřen vnější membránou.[39] Chemická stavba archeálních membrán je na rozdíl od jejich obecné struktury poměrně unikátní a liší se od membrán ostatních forem života, tedy bakterií a eukaryot.[40] U všech tří skupin se sice buněčné membrány skládají z fosfolipidů, které se skládají z hydrofilní a hydrofobní části, ale fosfolipidy archeí jsou v několika směrech neobvyklé. Za prvé, zatímco fosfolipidy archeí jsou složeny z glycerol-etherlipidů, bakterie a eukaryota mají v membráně především glycerol-esterlipidy.[41] Etherové vazby archeí jsou stabilnější, což může přispívat ke skutečnosti, že archea jsou schopna žít v extrémních teplotách a v kyselých i zásaditých prostředích.[42] Také lipidové „ocásky“ vykazují odlišnosti, u archeí jsou tvořeny především isoprenem,[43] u ostatních organismů jsou hlavní chemickou složkou mastné kyseliny. Isopreny jsou větvené a opět stabilnější za vyšších teplot.[44] Archea se liší i samotným typem glycerolu: archea mají jiný prostorový izomer (tzv. enantiomer) této molekuly než ostatní organismy. Ten má mírně odlišné chemické vlastnosti a z této skutečnosti se dá usuzovat na odlišný enzymový aparát v porovnání s ostatními doménami života.[40] U některých archeí se namísto běžné fosfolipidové dvouvrstvy vyskytuje jen jednovrstvá membrána. Na takto stavěné membráně jsou ocásky fosfolipidových molekul přiloženy k sobě, čímž v podstatě vzniká jediná molekula s dvěma polárními konci. Archea s tímto typem membrány jsou zřejmě odolnější k nepřízni životního prostředí.[45] Konkrétně je například acidofilní archea rodu Ferroplasma schopna odolávat nízkému pH.[46] Většina archeí má kolem své cytoplazmatické membrány rovněž buněčnou stěnu, která však není tvořená peptidoglykanem. Výjimkou jsou rody Thermoplasma a Ferroplasma, jež ji nemají vůbec.[47] Mnohá archea mají ve stěně tzv. S-vrstvu, tvořenou povrchovými proteiny.[48] Tato vrstva zajišťuje ochranu před chemickými i mechanickými vlivy. Specifickou buněčnou stěnu mají archea řádu Methanobacteriales, u nichž je základním stavebním prvkem pseudopeptidoglykan.[49] Archea mají poměrně často také bičík. Ten pracuje na podobném principu jako bičík bakteriální, tzn. díky rotaci struktury na bázi bičíku, poháněné protonovým gradientem. Přesto vykazuje archeální bičík odlišnosti ve stavbě a vývoji.[38] Bakteriální bičík se totiž pravděpodobně vyvinul ze sekrečního systému typu III, zatímco archeální má podle nedávné studie svůj prapůvod spíše v určitém typu bakteriálního pilusu.[50] Zajímavostí je, že u bakterií přirůstá bičík do délky na konci, kdežto u archeí dochází k prodlužování bičíku na bázi.[51]
Protoplast
Stavbou svého protoplastu (obsahu buněk) jsou archea výrazně srovnatelná s bakteriemi. To je také řadí mezi organismy prokaryotického typu. Neobsahují totiž žádné membránou obalené organely,[29] přesto se samozřejmě některé struktury v cytosolu vyskytují. Zásadní funkci v syntéze proteinů zaujímají ribozomy, drobné struktury složené z rRNA a proteinů. Ribozomy jsou u archeí i bakterií menší než u eukaryot a na základě tzv. sedimentačního koeficientu se označuje jejich malá podjednotka za 30S a velká za 50S. Sedimentační koeficient celého prokaryotického ribozomu je pak 70S.[52] Další podstatnou součástí protoplastu je DNA uspořádaná v nukleoidu a v plazmidech (viz kapitola genetika).
Metabolismus
Spektrum metabolických pochodů je u archeí pestré, dokáží používat mnoho různých zdrojů energie. Chemotrofní archea využívají k získávání energie buď anorganických (litotrofové) nebo organických sloučenin (organotrofové), oproti tomu fototrofové využívají energie slunečního záření. Mnoho základních metabolických drah je však velmi podobných těm, jež jsou známy u jiných forem života. Důležité je buněčné dýchání. Glykolýza (rozklad cukrů) je například mírně modifikována, ale princip zůstává stejný. Také Krebsův cyklus je u mnoha archeí stejný jako u ostatních domén.[53] Tyto podobnosti pravděpodobně odráží ranou evoluci života jako takového a existenci společného předka živých organismů.[54] První možností jsou anorganické látky (síra, amoniak), které slouží jako zdroj energie u tzv. litotrofů, včetně nitrifikačních, metanogenních druhů a anaerobních archeí, jež oxidují metan.[55] Metanogeni patří zejména do skupiny Euryarchaeota a vyznačují se specifickým typem metabolismu, při němž vzniká metan. Tento proces se odehrává například ve vhodných podmínkách v bažinaté půdě. Metanogeneze je pravděpodobně velmi starým způsobem získávání energie.[56] Akceptorem elektronů je v tomto případě oxid uhličitý a pomocí unikátních koenzymů (koenzym M, metanofuran) je oxidován vodík.[57] Akceptorem elektronů však nemusí být jen oxid uhličitý, nýbrž také alkoholy, kyselina octová či mravenčí. Mnohé z těchto reakcí probíhají u druhů střevní mikroflóry některých živočichů. U acetotrofních archeí z řádu Methanosarcinales dokonce probíhá přímo rozklad kyseliny octové na metan a oxid uhličitý (za vzniku bioplynu).[58] Zajímavou skupinou jsou archea, které fixují uhlík (autotrofie), a to pomocí energie z anorganických látek.[59] Jiným typem metabolismu archeí je fototrofie, při níž se k získávání energie využívá sluneční záření. Tento proces je však vždy tzv. anoxygenní, tedy na rozdíl od fotosyntézy u něj nevzniká kyslík.[60] V doméně archea nejsou známy žádné pravé fotosyntetizující organismy, které by nejen přeměňovaly sluneční energii na energii chemickou, ale rovněž ji využívaly k fixaci uhlíku, a tím ji ukládaly pro pozdější použití.[59] Fototrofní archea pomocí světla vyrábějí makroergické sloučeniny (s vysokým obsahem naakumulované energie), jako je ATP, určené k okamžité spotřebě. U archeí z třídy Halobacteria probíhá klasická fotofosforylace, tedy transport iontů přes buněčnou membránu za účelem výroby ATP. Jako přenašeče slouží například bakteriorodopsin a halorodopsin.[31]
Genetika
Genetickým materiálem archeí je obvykle jediný cirkulární řetězec DNA.[61] Jeho velikost se pohybuje od 5 751 492 párů bází u druhu Methanosarcina acetivorans,[62] až po pouhých 490 885 párů bází archea Nanoarchaeum equitans. Genom druhého jmenovaného druhu je jedním z nejmenších známých vůbec (menší má jen bakterie Carsonella ruddii[63]) a obsahuje pouze 537 genů kódujících protein.[64] Dalším nositelem genetické informace jsou plazmidy. Mohou být horizontálně šířeny procesem obdobným konjugaci bakterií.[65][66] Archea mají v porovnání s ostatními doménami života značně odlišný genom (posloupnost bází). Udává se, že až 15 % proteinů kódovaných u archeí je pro ně zcela unikátních a nevyskytuje se u bakterií ani eukaryot. Není zatím známa funkce většiny těchto genů,[67] jen o několika z nich se ví, že se účastní procesu metanogeneze. Naopak je známo množství genů, které jsou společné všem třem doménám života — ty se účastní zejména transkripce, translace a metabolismu nukleotidů.[68] Dále je známo, že u archeí se geny podobné funkce na řetězci DNA vyskytují blízko u sebe.[68] Procesy transkripce a translace jsou obecně příbuznější těm, které probíhají u eukaryot, než jejich bakteriálním obdobám. Patrná je zejména vzájemná podobnost eukaryotické a archeální RNA polymerázy a ribozomů těchto skupin.[61] Archeální RNA polymeráza má podobné uspořádání hlavních transkripčních faktorů, které řídí vazbu polymerázy na promotor, jako mají eukaryota. Na druhou stranu mnohé jiné transkripční faktory připomínají spíše bakterie.[69] Posttranskripční modifikace sice probíhají, ale vzhledem k tomu, že většina genů neobsahuje introny, jsou mnohem jednodušší než u eukaryot. Introny se však vyskytují u genů kódujících archeální tRNA a rRNA.[70] a vzácně u několika genů kódujících protein.[71][72]
Rozmnožování
Archea se rozmnožují výhradně nepohlavně, a to binárním dělením, fragmentací či pučením. Všichni potomci jednoho archea mají tedy víceméně stejný genetický materiál (meióza neprobíhá).[31] Buněčné dělení u archeí následuje jako jedna z fází buněčného cyklu poté, co se replikuje DNA a oddělí se dceřiné „chromozomy“.[73] Detaily buněčného cyklu jsou na základě studií rodu Sulfolobus podobné jak bakteriálním, tak eukaryotním obdobám. Ve srovnání s bakteriemi, u nichž replikace probíhá jen z jednoho místa, u archeí je těchto tzv. replikačního počátků zpravidla více. Také příslušné DNA polymerázy jsou podobné spíše eukaryotním DNA polymerázám.[74] Na druhou stranu mnohé proteiny řídící buněčné dělení a také stavba septa při dělení buněk jsou spíše podobné svým bakteriálním ekvivalentům.[73] U archeí nebyla objevena tvorba spor v bakteriologickém slova smyslu.[75] Přesto některá Haloarchaea střídají několik rozdílných morfologických typů buněk, včetně tlustostěnných struktur, které odolávají vysokému osmotickému tlaku na halofilních stanovištích. Ty se však nedají považovat za rozmnožovací útvary.[76]
Ekologie
Stanoviště

Archea jsou adaptována k životu na různých stanovištích a hrají velmi důležitou roli v globálním ekosystému,[6] neboť mimo jiné tvoří až 20 % celkové biomasy na Zemi.[77] Kdysi byla považována výlučně za obyvatele extrémních stanovišť (extrémofilové)[55], dnes je však známo velké množství mezofilních druhů, které žijí například v mokřadech, odpadních vodách, oceánech, v půdě[6] a na kořenech rostlin.[78] Ve světovém oceánu jsou archea významnou složkou planktonu[79] a mohou zde činit až 40 % veškeré mikrobiální biomasy. Jen malý počet těchto mořských druhů byl však vypěstován v čisté kultuře[80], a následkem toho jsou znalosti o ekologické roli archeí v moři jen útržkovité.[81] Extrémofilní archea lze rozdělit do čtyř základních fyziologických skupin: Jsou to halofilové (ve slané vodě), termofilové (ve vysoké teplotě), alkalofilové (v zásaditém prostředí) a acidofilové (v kyselém prostředí).[82] Tyto skupiny však dnes již primárně neslouží ke klasifikaci archeí do taxonomických skupin a některá archea lze zařadit do několika těchto skupin zároveň. Halofilní druhy archeí, jako je rod Halobacterium, žijí v extrémně slaném prostředí (slaná jezera atp.), a to zejména tehdy, přesahuje-li salinita 20–25 %.[55] Termofilní archea se nejlépe množí v teplotách nad 45 °C, jichž bývá dosaženo například v horkých vřídlech a navíc bývají vyčleňováni hypertermofilové, kteří mají optimum v teplotách vyšších než 80 °C.[83] Archeon jménem Strain 121 se dělí i při teplotách kolem 121 °C,[84], druh Methanopyrus kandleri i o jeden stupeň více. (122 °C).[85] Existují také psychrofilní archea, která vyhledávají velmi nízké teploty, například na dně chladných moří včetně okolí Antarktidy.[86][87] Další archea, alkalofilové a acidofilové, rostou v prostředí s extrémním pH.[82] Jedním z nejvýraznějších příkladů acidofilie je Picrophilus torridus, který žije v pH 0, tedy v podobném pH, jaké má 1,2molární kyselina sírová.[88] Na základě těchto vlastností se spekulovalo o existenci mimozemského života[89] například na Marsu.[90] Dokonce se uvažuje o tom, že by mohly mikroorganismy podobného typu být mezi planetami přenášeny pomocí meteoritů.[91]
Role v koloběhu živin
Archea jsou také významnou součástí biogeochemických cyklů prvků, jako je uhlík, dusík či síra. V koloběhu dusíku se archea zapojují nejen do rozkladných procesů, které zpravidla dusík z ekosystému odstraňují (například denitrifikace či respirace za pomoci dusičnanů), ale i do procesů, které dusík živým organismům zpřístupňují (fixace dusíku a asimilace dusičnanů).[92] V oceánech i v půdě se archea účastní oxidace amoniaku.[93][94][95] Do koloběhu síry se zapojují archea, která oxidují sloučeniny síry, a uvolňují ji tak z hornin. Tak se tento prvek stává dostupným jiným organismům. Někdy však mohou archea (jako Sulfolobus) svými metabolickými pochody ničit životní prostředí tím, že jako odpadní produkt vylučují kyselinu sírovou.[96] V koloběhu uhlíku jsou zásadní metanogeni, tedy producenti metanu. Schopnost těchto archeí odstraňovat vodík z organických látek v sedimentech, mokřadech a čističkách odpadních vod je důležitá pro rozklad těchto látek.[97] Druhou stranou mince je skutečnost, že metan je významný skleníkový plyn, zodpovědný z 18 % za skleníkový efekt.[98]
Ekologické vztahy s jinými organismy

Ekologie rozeznává několik druhů ekologických vztahů (symbiózy v širším slova smyslu), a to zejména mutualismus, komenzálismus a parazitismus. V současné době věda nezná žádný parazitický či patogenní druh z domény archea,[99] přestože jeho existence není vyloučena.[100] Některé studie dávají do souvislosti přítomnost některých metanogenních archeí v ústní mikroflóře a onemocnění paradontózou.[101][102] Také Nanoarchaeum equitans může být parazitický, jelikož dokáže žít pouze v buňkách archea Ignicoccus hospitalis[103] a pravděpodobně hostiteli neposkytuje žádné výhody.[104] Naopak je známo mnoho oboustranně výhodných, tedy mutualistických vztahů. Příkladem jsou vztahy mezi prvoky a metanogenními archei v trávicí soustavě přežvýkavců a termitů.[105] V těchto anaerobních podmínkách vzniká při rozkladu celulózy symbiotickými prvoky velké množství vodíku, který snižuje efektivitu dalších rozkladných reakcí. Snižování efektivnosti rozkladu zamezují metanogenní archea, která vodík metabolizují. Jedná se tedy o oboustranně výhodný vztah, při němž jeden mikroorganismus tráví odpadní produkty organismu druhého.[106] U některých druhů prvoků (např. Plagiopyla frontata) se dokonce archea usadila přímo v buňce prvoka a zde v organele zvané hydrogenozom metabolizují vodík na metan.[107][108] Nalézána jsou i archea žijící uvnitř mnohobuněčných organismů. Příkladem je archeon Cenarchaeum symbiosum, které žije uvnitř těla houbovce Axinella mexicana.[109] Je známo i mnoho komenzálických archeí. Příkladem je nejčastější archeon v lidském střevě, Methanobrevibacter smithii, který představuje asi desetinu všech prokaryotických organismů ve střevě.[110] Není přitom vyloučeno, že tato archea mají mutualistickou povahu a že podobně jako například u termitů pomáhají trávit potravu.[111] Kolonie archeí se nacházejí i na mnoha jiných organismech, jako jsou koráli[112] či rhizosféra rostlin.[113][114] Do kategorie ekologických vztahů patří i skutečnost, že archea mohou být infikována dvouvláknovými DNA viry, které jsou virologicky zcela unikátní. Tyto viry mají různé neobvyklé tvary, mohou připomínat láhev, zahnutou tyčinku či kapku,[115] a byly studovány zejména u termofilních archeí z řádů Sulfolobales a Thermoproteales.[116] Archea se proti virové nákaze brání například RNA interferencí.[117][118]
Význam v technologiích a průmyslu
Archea mají nezanedbatelný význam pro člověka i v technologiích a průmyslu. Mnohá extrémofilní archea jsou například zdrojem enzymů, které umí pracovat i v drsných podmínkách prostředí, k nimž jsou právě tato archea přizpůsobena.[119][120] Příkladem užití enzymů je archeální DNA polymeráza, jíž se používá jako katalyzátoru v procesu polymerázové řetězové reakce (způsob jak namnožit DNA). V potravinářském průmyslu našly své místo enzymy amylázy, galaktosidázy a pululanáza, izolované z archeí rodu Pyrococcus — i při teplotě přesahující bod varu si stále zachovávají svou katalytickou funkci, a mohou se tak použít k výrobě potravin (např. mléka a syrovátky s nízkým obsahem cukru laktózy).[121] Tyto enzymy jsou také odolné vůči organickým rozpouštědlům, a díky tomu se mohou používat i v průmyslu chemickém.[120] Ačkoliv archeální enzymy své místo v průmyslu již našly, samotná archea se zapojují do biotechnologických procesů jen velmi omezeně. Přesto se výjimky najdou: metanogenní archea se užívají pro biologické odbourávání látek v rámci čištění odpadních vod jako součást technologického procesu anaerobní digesce. Zde mohou právě archea sloužit k produkci bioplynu.[122] V hornictví možná najdou své místo archea, která jsou schopná vyextrahovat zlato, kobalt a měď z hornin.[123] U některých archeí (především u Haloarchaea a rodu Sulfolobus[124]) byly objeveny látky s antibiotickým účinkem, tzv. archaeociny, a je možné, že jich u archeí existují stovky různých druhů. Tyto sloučeniny pravděpodobně mají zcela jiné mechanismy účinku než dnes známá antibiotika. Překážku však zatím představuje problém s kultivací archeí.[125]
Reference
- ↑ 1,0 1,1 Woese C. R., Kandler O., Wheelis M. L. Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya. Proc. Natl. Acad. Sci. U.S.A., 1990, roč. 87, čís. 12, s. 4576–9. Dostupné online. DOI:10.1073/pnas.87.12.4576. PMID 2112744.
- ↑ Staley J. T. The bacterial species dilemma and the genomic-phylogenetic species concept. Philos. Trans. R. Soc. Lond., B, Biol. Sci., 2006, roč. 361, čís. 1475, s. 1899–909. Dostupné online. DOI:10.1098/rstb.2006.1914. PMID 17062409.
- ↑ NRC Institute for Biological Sciences. Bacterial Culture Facility - Current Activities [online]. . Dostupné online.
- ↑ Zuckerkandl E., Pauling L. Molecules as documents of evolutionary history. J. Theor. Biol., 1965, roč. 8, čís. 2, s. 357–66. DOI:10.1016/0022-5193(65)90083-4. PMID 5876245.
- ↑ Woese C., Fox G. Phylogenetic structure of the prokaryotic domain: the primary kingdoms. Proc Natl Acad Sci USA, 1977, roč. 74, čís. 11, s. 5088–90. Dostupné online. DOI:10.1073/pnas.74.11.5088. PMID 270744.
- ↑ 6,0 6,1 6,2 DeLong E. F.. Everything in moderation: archaea as 'non-extremophiles'. Curr. Opin. Genet. Dev., 1998, roč. 8, čís. 6, s. 649–54. DOI:10.1016/S0959-437X(98)80032-4. PMID 9914204.
- ↑ Theron J., Cloete T.E.. Molecular techniques for determining microbial diversity and community structure in natural environments. Crit. Rev. Microbiol., 2000, roč. 26, čís. 1, s. 37–57. DOI:10.1080/10408410091154174. PMID 10782339.
- ↑ Schmidt T. M.. The maturing of microbial ecology. Int. Microbiol., 2006, roč. 9, čís. 3, s. 217–23. Dostupné online. PMID 17061212.
- ↑ Gevers D., Dawyndt P., Vandamme P., et al. Stepping stones towards a new prokaryotic taxonomy. Philos. Trans. R. Soc. Lond., B, Biol. Sci., 2006, roč. 361, čís. 1475, s. 1911–6. Dostupné online. DOI:10.1098/rstb.2006.1915. PMID 17062410.
- ↑ 10,0 10,1 Robertson C. E., Harris J. K., Spear J. R., Pace N. R.. Phylogenetic diversity and ecology of environmental Archaea. Curr. Opin. Microbiol., 2005, roč. 8, čís. 6, s. 638–42. PMID 16236543.
- ↑ Huber H., Hohn M. J., Rachel R., Fuchs T., Wimmer V. C., Stetter K. O.. A new phylum of Archaea represented by a nanosized hyperthermophilic symbiont.. Nature, 2002, roč. 417, čís. 6884, s. 27–8. DOI:10.1038/417063a. PMID 11986665.
- ↑ Barns S. M., Delwiche C. F., Palmer J. D., Pace N. R.. Perspectives on archaeal diversity, thermophily and monophyly from environmental rRNA sequences. Proc. Natl. Acad. Sci. U.S.A., 1996, roč. 93, čís. 17, s. 9188–93. Dostupné online. DOI:10.1073/pnas.93.17.9188. PMID 8799176.
- ↑ Elkins J. G., Podar M., Graham D. E., et al. A korarchaeal genome reveals insights into the evolution of the Archaea. Proc. Natl. Acad. Sci. U.S.A., June 2008, roč. 105, čís. 23, s. 8102–7. Dostupné online. DOI:10.1073/pnas.0801980105. PMID 18535141.
- ↑ Brochier-Armanet C., Boussau B., Gribaldo S., Forterre P.. Mesophilic crenarchaeota: proposal for a third archaeal phylum, the Thaumarchaeota.. Nature Reviews Microbiology, 2008, roč. 6, s. 245-252. DOI:10.1038/nrmicro1852.
- ↑ Baker, B .J., Tyson, G .W., Webb, R. I., Flanagan, J., Hugenholtz, P. and Banfield, J.F.. Lineages of acidophilic Archaea revealed by community genomic analysis. Science. Science, 2006, roč. 314, čís. 6884, s. 1933 – 1935. DOI:10.1126/science.1132690. PMID 17185602.
- ↑ de Queiroz K.. Ernst Mayr and the modern concept of species. Proc. Natl. Acad. Sci. U.S.A., 2005, roč. 102 Suppl 1, s. 6600–7. Dostupné online. DOI:10.1073/pnas.0502030102. PMID 15851674.
- ↑ Eppley J. M., Tyson G. W., Getz W. M., Banfield J. F.. Genetic exchange across a species boundary in the archaeal genus ferroplasma. Genetics, 2007, roč. 177, čís. 1, s. 407–16. Dostupné online. DOI:10.1534/genetics.107.072892. PMID 17603112.
- ↑ Papke R. T., Zhaxybayeva O., Feil E. J., Sommerfeld K., Muise D., Doolittle W. .F. Searching for species in haloarchaea. Proc. Natl. Acad. Sci. U.S.A., 2007, roč. 104, čís. 35, s. 14092–7. Dostupné online. DOI:10.1073/pnas.0706358104. PMID 17715057.
- ↑ Hugenholtz P.. Exploring prokaryotic diversity in the genomic era. Genome Biol., 2002, roč. 3, čís. 2, s. REVIEWS0003. Dostupné online. DOI:10.1186/gb-2002-3-2-reviews0003. PMID 11864374.
- ↑ Schopf J.. Fossil evidence of Archaean life. Philos Trans R Soc Lond B Biol Sci, 2006, roč. 361, čís. 1470, s. 869–85. Dostupné online. DOI:10.1098/rstb.2006.1834. PMID 16754604.
- ↑ Brocks J. J., Logan G. A., Buick R., Summons R. E.. Archean molecular fossils and the early rise of eukaryotes. Science, 1999, roč. 285, čís. 5430, s. 1033–6. DOI:10.1126/science.285.5430.1033. PMID 10446042.
- ↑ HAHN, Jürgen, Pat Haug Traces of Archaebacteria in ancient sediments. System Applied Microbiology, 1986, roč. 7, čís. Archaebacteria '85 Proceedings, s. 178–83.
- ↑ Wang M., Yafremava L. S., Caetano-Anollés D., Mittenthal J. E., Caetano-Anollés G.. Reductive evolution of architectural repertoires in proteomes and the birth of the tripartite world. Genome Res., 2007, roč. 17, čís. 11, s. 1572–85. DOI:10.1101/gr.6454307. PMID 17908824.
- ↑ Woese C. R., Gupta R.. Are archaebacteria merely derived 'prokaryotes'?. Nature, 1981, roč. 289, čís. 5793, s. 95–6. DOI:10.1038/289095a0. PMID 6161309.
- ↑ Woese C.. The universal ancestor. Proc. Natl. Acad. Sci. U.S.A., 1998, roč. 95, čís. 12, s. 6854–9. Dostupné online. DOI:10.1073/pnas.95.12.6854. PMID 9618502.
- ↑ Gupta R. S.. The natural evolutionary relationships among prokaryotes. Crit. Rev. Microbiol., 2000, roč. 26, čís. 2, s. 111–31. DOI:10.1080/10408410091154219. PMID 10890353.
- ↑ Gouy M., Li W. H.. Phylogenetic analysis based on rRNA sequences supports the archaebacterial rather than the eocyte tree. Nature, May 1989, roč. 339, čís. 6220, s. 145–7. DOI:10.1038/339145a0. PMID 2497353.
- ↑ Yutin N., Makarova K. S., Mekhedov S. L., Wolf YI, Koonin EV. The deep archaeal roots of eukaryotes. Mol. Biol. Evol., May 2008. Dostupné online. DOI:10.1093/molbev/msn108. PMID 18463089.
- ↑ 29,0 29,1 Woese C. R.. There must be a prokaryote somewhere: microbiology's search for itself. Microbiol. Rev., March 1994, roč. 58, čís. 1, s. 1–9. Dostupné online. PMID 8177167.
- ↑ Nelson K. E., Clayton RA, Gill SR, et al. Evidence for lateral gene transfer between Archaea and bacteria from genome sequence of Thermotoga maritima. Nature, 1999, roč. 399, čís. 6734, s. 323–9. DOI:10.1038/20601. PMID 10360571.
- ↑ 31,0 31,1 31,2 31,3 KRIEG, Noel. Bergey’s Manual® of Systematic Bacteriology. USA : Springer, 2005. ISBN 978-0-387-24143-2. S. 21–6.
- ↑ Barns, Sue and Burggraf, Siegfried.. Crenarchaeota, The Tree of Life Web Project [online]. . Crenarchaeota Dostupné online.
- ↑ Walsby, A. E.. A square bacterium. Nature, 1980, roč. 283, čís. 5742, s. 69–71. DOI:10.1038/283069a0.
- ↑ Hixon W. G., Searcy D. G.. Cytoskeleton in the archaebacterium Thermoplasma acidophilum? Viscosity increase in soluble extracts. BioSystems, 1993, roč. 29, čís. 2–3, s. 151–60. DOI:10.1016/0303-2647(93)90091-P. PMID 8374067.
- ↑ Hall-Stoodley L., Costerton J. W., Stoodley P.. Bacterial biofilms: from the natural environment to infectious diseases. Nat. Rev. Microbiol., 2004, roč. 2, čís. 2, s. 95–108. DOI:10.1038/nrmicro821. PMID 15040259.
- ↑ Nickell S., Hegerl R., Baumeister W., Rachel R.. Pyrodictium cannulae enter the periplasmic space but do not enter the cytoplasm, as revealed by cryo-electron tomography. J. Struct. Biol., 2003, roč. 141, čís. 1, s. 34–42. Dostupné online. DOI:10.1016/S1047-8477(02)00581-6. PMID 12576018.
- ↑ Kuwabara T., Minaba M., Iwayama Y., et al. Thermococcus coalescens sp. nov., a cell-fusing hyperthermophilic archaeon from Suiyo Seamount. Int. J. Syst. Evol. Microbiol., November 2005, roč. 55, čís. Pt 6, s. 2507–14. Dostupné online. DOI:10.1099/ijs.0.63432-0. PMID 16280518.
- ↑ 38,0 38,1 Thomas N. A., Bardy S. L., Jarrell K. F.. The archaeal flagellum: a different kind of prokaryotic motility structure. FEMS Microbiol. Rev., 2001, roč. 25, čís. 2, s. 147–74. DOI:10.1111/j.1574-6976.2001.tb00575.x. PMID 11250034.
- ↑ Rachel R., Wyschkony I., Riehl S., Huber H.. The ultrastructure of Ignicoccus: evidence for a novel outer membrane and for intracellular vesicle budding in an archaeon. Archaea, March 2002, roč. 1, čís. 1, s. 9–18. Dostupné online. PMID 15803654.
- ↑ 40,0 40,1 Koga Y., Morii H.. Biosynthesis of ether-type polar lipids in archaea and evolutionary considerations. Microbiol. Mol. Biol. Rev., 2007, roč. 71, čís. 1, s. 97–120. Dostupné online. DOI:10.1128/MMBR.00033-06. PMID 17347520.
- ↑ De Rosa M., Gambacorta A., Gliozzi A.. Structure, biosynthesis, and physicochemical properties of archaebacterial lipids. Microbiol. Rev., 1986, roč. 50, čís. 1, s. 70–80. Dostupné online. PMID 3083222.
- ↑ Albers S. V., van de Vossenberg J. L., Driessen A. J., Konings W. N.. Adaptations of the archaeal cell membrane to heat stress. Front. Biosci., září 2000, roč. 5, s. D813–20. Dostupné online. PMID 10966867.
- ↑ Damsté J. S., Schouten S., Hopmans E. C., van Duin A. C., Geenevasen J. A.. Crenarchaeol: the characteristic core glycerol dibiphytanyl glycerol tetraether membrane lipid of cosmopolitan pelagic crenarchaeota. J. Lipid Res., October 2002, roč. 43, čís. 10, s. 1641–51. Dostupné online. PMID 12364548.
- ↑ Koga Y., Morii H.. Recent advances in structural research on ether lipids from archaea including comparative and physiological aspects. Biosci. Biotechnol. Biochem., November 2005, roč. 69, čís. 11, s. 2019–34. Dostupné online. PMID 16306681.
- ↑ Hanford M. J., Peeples T. L.. Archaeal tetraether lipids: unique structures and applications. Appl. Biochem. Biotechnol., January 2002, roč. 97, čís. 1, s. 45–62. PMID 11900115.
- ↑ Macalady J. L., Vestling M. M., Baumler D., Boekelheide N., Kaspar C. W., Banfield J. F.. Tetraether-linked membrane monolayers in Ferroplasma spp: a key to survival in acid. Extremophiles, October 2004, roč. 8, čís. 5, s. 411–9. PMID 15258835.
- ↑ Golyshina O. V., Pivovarova T. A., Karavaiko G. I., et al. Ferroplasma acidiphilum gen. nov., sp. nov., an acidophilic, autotrophic, ferrous-iron-oxidizing, cell-wall-lacking, mesophilic member of the Ferroplasmaceae fam. nov., comprising a distinct lineage of the Archaea. Int. J. Syst. Evol. Microbiol., May 2000, roč. 50 Pt 3, s. 997–1006. Dostupné online. PMID 10843038.
- ↑ Sára M., Sleytr U. B.. S-Layer proteins. J. Bacteriol., 2000, roč. 182, čís. 4, s. 859–68. Dostupné online. DOI:10.1128/JB.182.4.859-868.2000. PMID 10648507.
- ↑ Cell wall polymers in Archaea (Archaebacteria). Cellular and Molecular Life Sciences (CMLS), 1998, roč. 54, čís. 4, s. 305–308. Dostupné online. DOI:10.1007/s000180050156.
- ↑ Ng S. Y., Chaban B., Jarrell K. F.. Archaeal flagella, bacterial flagella and type IV pili: a comparison of genes and posttranslational modifications. J. Mol. Microbiol. Biotechnol., 2006, roč. 11, čís. 3–5, s. 167–91. DOI:10.1159/000094053. PMID 16983194.
- ↑ Bardy S. L., Ng S. Y., Jarrell K. F.. Prokaryotic motility structures. Microbiology (Reading, Engl.), February 2003, roč. 149, čís. Pt 2, s. 295–304. Dostupné online. DOI:10.1099/mic.0.25948-0. PMID 12624192.
- ↑ ROSYPAL, Stanislav. Nový přehled biologie. [s.l.] : Scientia, 2003. S. 797.
- ↑ Zillig W.. Comparative biochemistry of Archaea and Bacteria. Curr. Opin. Genet. Dev., December 1991, roč. 1, čís. 4, s. 544–51. PMID 1822288.
- ↑ Romano A., Conway T.. Evolution of carbohydrate metabolic pathways. Res Microbiol, 1996, roč. 147, čís. 6–7, s. 448–55. DOI:10.1016/0923-2508(96)83998-2. PMID 9084754.
- ↑ 55,0 55,1 55,2 Valentine D. L.. Adaptations to energy stress dictate the ecology and evolution of the Archaea. Nat. Rev. Microbiol., 2007, roč. 5, čís. 4, s. 316–23. DOI:10.1038/nrmicro1619. PMID 17334387.
- ↑ Koch A.. How did bacteria come to be?. Adv Microb Physiol, 1998, roč. 40, s. 353–99. PMID 9889982.
- ↑ DiMarco A. A., Bobik T. A., Wolfe R. S.. Unusual coenzymes of methanogenesis. Annu. Rev. Biochem., 1990, roč. 59, s. 355–94. DOI:10.1146/annurev.bi.59.070190.002035. PMID 2115763.
- ↑ Klocke M., Nettmann E., Bergmann I, et al. Characterization of the methanogenic Archaea within two-phase biogas reactor systems operated with plant biomass. Syst. Appl. Microbiol., May 2008. DOI:10.1016/j.syapm.2008.02.003. PMID 18501543.
- ↑ 59,0 59,1 Bryant D. A., Frigaard N. U.. Prokaryotic photosynthesis and phototrophy illuminated. Trends Microbiol., November 2006, roč. 14, čís. 11, s. 488–96. DOI:10.1016/j.tim.2006.09.001. PMID 16997562.
- ↑ Schäfer G., Engelhard M., Müller V.. Bioenergetics of the Archaea. Microbiol. Mol. Biol. Rev., September 1999, roč. 63, čís. 3, s. 570–620. Dostupné online. PMID 10477309.
- ↑ 61,0 61,1 Allers T., Mevarech M.. Archaeal genetics - the third way. Nat. Rev. Genet., 2005, roč. 6, čís. 1, s. 58–73. DOI:10.1038/nrg1504. PMID 15630422.
- ↑ Galagan J. E., et al. The genome of M. acetivorans reveals extensive metabolic and physiological diversity. Genome Research, 2002, roč. 12, čís. 4, s. 532–42. Dostupné online. ISSN 1088-9051. DOI:11932238.
- ↑ Nakabachi A., Yamashita A., Toh H., Ishikawa H., Dunbar H., Moran N., Hattori M.. The 160-kilobase genome of the bacterial endosymbiont Carsonella. Science, 2006, roč. 314, čís. 5797, s. 267.
- ↑ Waters E., Hohn M. J., Ahel I., et al. The genome of Nanoarchaeum equitans: insights into early archaeal evolution and derived parasitism. Proc. Natl. Acad. Sci. U.S.A., 2003, roč. 100, čís. 22, s. 12984–8. Dostupné online. DOI:10.1073/pnas.1735403100. PMID 14566062.
- ↑ Schleper C., Holz I., Janekovic D., Murphy J., Zillig W.. A multicopy plasmid of the extremely thermophilic archaeon Sulfolobus effects its transfer to recipients by mating. J. Bacteriol., 1995, roč. 177, čís. 15, s. 4417–26. Dostupné online. PMID 7635827.
- ↑ Sota M.; Top E. M.. Plasmids: Current Research and Future Trends. [s.l.] : Caister Academic Press, 2008. ISBN 978-1-904455-35-6. Kapitola Horizontal Gene Transfer Mediated by Plasmids.
- ↑ Graham D. E., Overbeek R, Olsen GJ, Woese CR. An archaeal genomic signature. Proc. Natl. Acad. Sci. U.S.A., 2000, roč. 97, čís. 7, s. 3304–8. Dostupné online. DOI:10.1073/pnas.050564797. PMID 10716711.
- ↑ 68,0 68,1 Gaasterland T.. Archaeal genomics. Curr. Opin. Microbiol., 1999, roč. 2, čís. 5, s. 542–7. DOI:10.1016/S1369-5274(99)00014-4. PMID 10508726.
- ↑ Aravind L., Koonin E. V.. DNA-binding proteins and evolution of transcription regulation in the archaea. Nucleic Acids Res., 1999, roč. 27, čís. 23, s. 4658–70. Dostupné online. DOI:10.1093/nar/27.23.4658. PMID 10556324.
- ↑ Lykke-Andersen J., Aagaard C., Semionenkov M., Garrett R. A.. Archaeal introns: splicing, intercellular mobility and evolution. Trends Biochem. Sci., September 1997, roč. 22, čís. 9, s. 326–31. PMID 9301331.
- ↑ Watanabe Y., Yokobori S., Inaba T., et al. Introns in protein-coding genes in Archaea. FEBS Lett., January 2002, roč. 510, čís. 1-2, s. 27–30. PMID 11755525.
- ↑ Yoshinari S., Itoh T., Hallam S. J., et al. Archaeal pre-mRNA splicing: a connection to hetero-oligomeric splicing endonuclease. Biochem. Biophys. Res. Commun., August 2006, roč. 346, čís. 3, s. 1024–32. DOI:10.1016/j.bbrc.2006.06.011. PMID 16781672.
- ↑ 73,0 73,1 Bernander R.. Archaea and the cell cycle. Mol. Microbiol., 1998, roč. 29, čís. 4, s. 955–61. DOI:10.1046/j.1365-2958.1998.00956.x. PMID 9767564.
- ↑ Kelman L. M., Kelman Z. Multiple origins of replication in archaea. Trends Microbiol., 2004, roč. 12, čís. 9, s. 399–401. DOI:10.1016/j.tim.2004.07.001. PMID 153371581.
- ↑ Onyenwoke R. U., Brill J. A., Farahi K., Wiegel J.. Sporulation genes in members of the low G+C Gram-type-positive phylogenetic branch ( Firmicutes). Arch. Microbiol., 2004, roč. 182, čís. 2–3, s. 182–92. DOI:10.1007/s00203-004-0696-y. PMID 15340788.
- ↑ Kostrikina N. A., Zvyagintseva I. S., Duda V. I.. Cytological peculiarities of some extremely halophilic soil archaeobacteria. Arch. Microbiol., 1991, roč. 156, čís. 5, s. 344–49. DOI:10.1007/BF00248708.
- ↑ DeLong E. F., Pace N. R.. Environmental diversity of bacteria and archaea. Syst. Biol., 2001, roč. 50, čís. 4, s. 470–8. DOI:10.1080/106351501750435040. PMID 12116647.
- ↑ SIMON, H M, J A Dodsworth, R M Goodman Crenarchaeota colonize terrestrial plant roots. Environmental Microbiology, 2000, roč. 2, čís. 5, s. 495-505. Dostupné online. ISSN 1462-2912. DOI:11233158.
- ↑ Karner M. B., DeLong E. F., Karl D. M.. Archaeal dominance in the mesopelagic zone of the Pacific Ocean. Nature, 2001, roč. 409, čís. 6819, s. 507–10. DOI:10.1038/35054051. PMID 11206545.
- ↑ Giovannoni S. J., Stingl U.. Molecular diversity and ecology of microbial plankton. Nature, 2005, roč. 427, čís. 7057, s. 343–8. DOI:10.1038/nature04158. PMID 16163344.
- ↑ DeLong E. F., Karl D. M.. Genomic perspectives in microbial oceanography. Nature, September 2005, roč. 437, čís. 7057, s. 336–42. DOI:10.1038/nature04157. PMID 16163343.
- ↑ 82,0 82,1 Pikuta E. V., Hoover R. B., Tang J.. Microbial extremophiles at the limits of life. Crit. Rev. Microbiol., 2007, roč. 33, čís. 3, s. 183–209. DOI:10.1080/10408410701451948. PMID 17653987.
- ↑ Madigan M. T., Martino J. M.. Brock Biology of Microorganisms. 11th ed.. vyd. [s.l.] : Pearson, 2006. ISBN 0-13-196893-9. S. 136.
- ↑ Cowen D. A.. The upper temperature of life—where do we draw the line?. Trends Microbiol., February 2004, roč. 12, čís. 2, s. 58–60. PMID 15040324.
- ↑ Takai K, Nakamura K, Toki T, Tsunogai U, Miyazaki M, Miyazaki J, Hirayama H, Nakagawa S, Nunoura T, Horikoshi K. Cell proliferation at 122 °C and isotopically heavy CH4 production by a hyperthermophilic methanogen under high-pressure cultivation. Proc Natl Acad Sci USA, 2008, roč. 105, s. 10949–54. DOI:10.1073/pnas.0712334105.
- ↑ Teske A., Sørensen K. B.. Uncultured archaea in deep marine subsurface sediments: have we caught them all?. ISME J, January 2008, roč. 2, čís. 1, s. 3–18. DOI:10.1038/ismej.2007.90. PMID 18180743.
- ↑ López-García P., López-López A., Moreira D., Rodríguez-Valera F.. Diversity of free-living prokaryotes from a deep-sea site at the Antarctic Polar Front. FEMS Microbiol. Ecol., July 2001, roč. 36, čís. 2–3, s. 193–202. PMID 11451524.
- ↑ Ciaramella M., Napoli A., Rossi M.. Another extreme genome: how to live at pH 0. Trends Microbiol., February 2005, roč. 13, čís. 2, s. 49–51. DOI:10.1016/j.tim.2004.12.001. PMID 15680761.
- ↑ Javaux E. J.. Extreme life on Earth—past, present and possibly beyond. Res. Microbiol., 2006, roč. 157, čís. 1, s. 37–48. DOI:10.1016/j.resmic.2005.07.008. PMID 16376523.
- ↑ Nealson K. H.. Post-Viking microbiology: new approaches, new data, new insights. Orig Life Evol Biosph, January 1999, roč. 29, čís. 1, s. 73–93. Dostupné online. PMID 11536899.
- ↑ Davies P. C.. The transfer of viable microorganisms between planets. Ciba Found. Symp., 1996, roč. 202, s. 304–14; discussion 314–7. PMID 9243022.
- ↑ Cabello P., Roldán M. D., Moreno-Vivián C.. Nitrate reduction and the nitrogen cycle in archaea. Microbiology (Reading, Engl.), November 2004, roč. 150, čís. Pt 11, s. 3527–46. Dostupné online. DOI:10.1099/mic.0.27303-0. PMID 15528644.
- ↑ Francis C. A., Beman J. M., Kuypers M. M.. New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation. ISME J, May 2007, roč. 1, čís. 1, s. 19–27. DOI:10.1038/ismej.2007.8. PMID 18043610.
- ↑ Coolen M. J., Abbas B., van Bleijswijk J., et al. Putative ammonia-oxidizing Crenarchaeota in suboxic waters of the Black Sea: a basin-wide ecological study using 16S ribosomal and functional genes and membrane lipids. Environ. Microbiol., April 2007, roč. 9, čís. 4, s. 1001–16. DOI:10.1111/j.1462-2920.2006.01227.x. PMID 17359272.
- ↑ Leininger S., Urich T., Schloter M., et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils. Nature, August 2006, roč. 442, čís. 7104, s. 806–9. DOI:10.1038/nature04983. PMID 16915287.
- ↑ Brock T. D., Gustafson J.. Ferric iron reduction by sulfur- and iron-oxidizing bacteria. Appl. Environ. Microbiol., October 1976, roč. 32, čís. 4, s. 567–71. Dostupné online. PMID 825043.
- ↑ Schimel J.. Playing scales in the methane cycle: from microbial ecology to the globe. Proc. Natl. Acad. Sci. U.S.A., August 2004, roč. 101, čís. 34, s. 12400–1. Dostupné online. DOI:10.1073/pnas.0405075101. PMID 15314221.
- ↑ EDGAR 3.2 Fast Track 2000 [online]. [cit. 2008-06-26]. Dostupné online.
- ↑ Cavicchioli R., Curmi P., Saunders N., Thomas T.. Pathogenic archaea: do they exist?. Bioessays, 2003, roč. 25, čís. 11, s. 1119–28. DOI:10.1002/bies.10354. PMID 14579252.
- ↑ Eckburg P., Lepp P., Relman D.. Archaea and their potential role in human disease. Infect Immun, 2003, roč. 71, čís. 2, s. 591–6. DOI:10.1128/IAI.71.2.591-596.2003. PMID 12540534.
- ↑ Lepp P., Brinig M., Ouverney C., Palm K., Armitage G., Relman D.. Methanogenic Archaea and human periodontal disease. Proc Natl Acad Sci U S A, 2004, roč. 101, čís. 16, s. 6176–81. DOI:10.1073/pnas.0308766101. PMID 15067114.
- ↑ Vianna M. E., Conrads G., Gomes B. P., Horz H. P.. Identification and quantification of archaea involved in primary endodontic infections. J. Clin. Microbiol., April 2006, roč. 44, čís. 4, s. 1274–82. Dostupné online. DOI:10.1128/JCM.44.4.1274-1282.2006. PMID 16597851.
- ↑ Waters E., Hohn M. J., Ahel I., et al. The genome of Nanoarchaeum equitans: insights into early archaeal evolution and derived parasitism. Proc. Natl. Acad. Sci. U.S.A., October 2003, roč. 100, čís. 22, s. 12984–8. Dostupné online. DOI:10.1073/pnas.1735403100. PMID 14566062.
- ↑ Jahn U., Gallenberger M., Paper W., et al. Nanoarchaeum equitans and Ignicoccus hospitalis: new insights into a unique, intimate association of two archaea. J. Bacteriol., March 2008, roč. 190, čís. 5, s. 1743–50. Dostupné online. DOI:10.1128/JB.01731-07. PMID 18165302.
- ↑ Chaban B., Ng S. Y., Jarrell K. F.. Archaeal habitats—from the extreme to the ordinary. Can. J. Microbiol., February 2006, roč. 52, čís. 2, s. 73–116. DOI:10.1139/w05-147. PMID 16541146.
- ↑ Schink B.. Energetics of syntrophic cooperation in methanogenic degradation. Microbiol. Mol. Biol. Rev., June 1997, roč. 61, čís. 2, s. 262–80. Dostupné online. PMID 9184013.
- ↑ Lange, M.; Westermann, P.; Ahring, B.K.. Archaea in protozoa and metazoa. Applied Microbiology and Biotechnology, 2005, roč. 66, čís. 5, s. 465–474.
- ↑ van Hoek A. H., van Alen T. A., Sprakel V. S., et al. Multiple acquisition of methanogenic archaeal symbionts by anaerobic ciliates. Mol. Biol. Evol., February 2000, roč. 17, čís. 2, s. 251–8. Dostupné online. PMID 10677847.
- ↑ Preston, C.M.; Wu, K.Y.; Molinski, T.F.; Delong, E.F.. A psychrophilic crenarchaeon inhabits a marine sponge: Cenarchaeum symbiosum gen. nov., sp. nov.. Proc Natl Acad Sci USA, 1996, roč. 93, čís. 13, s. 6241–6246. Dostupné online. DOI:10.1073/pnas.93.13.6241. PMID 8692799.
- ↑ Eckburg P. B., Bik E. M., Bernstein C. N., et al. Diversity of the human intestinal microbial flora. Science (periodikum), June 2005, roč. 308, čís. 5728, s. 1635–8. Dostupné online. DOI:10.1126/science.1110591. PMID 15831718.
- ↑ Samuel B. S., Gordon J. I.. A humanized gnotobiotic mouse model of host-archaeal-bacterial mutualism. Proc. Natl. Acad. Sci. U.S.A., June 2006, roč. 103, čís. 26, s. 10011–6. DOI:10.1073/pnas.0602187103. PMID 16782812.
- ↑ Wegley, L.; Yu, Y.; Breitbart, M.; Casas, V.; Kline, D.I.; Rohwer, F.. Coral-associated Archaea. Marine Ecology Progress Series, 2004, roč. 273, s. 89–96. Dostupné online.
- ↑ Chelius M. K., Triplett EW. The Diversity of Archaea and Bacteria in Association with the Roots of Zea mays L. Microb. Ecol., April 2001, roč. 41, čís. 3, s. 252–63. DOI:10.1007/s002480000087. PMID 11391463.
- ↑ Simon H. M., Dodsworth J. A., Goodman R. M.. Crenarchaeota colonize terrestrial plant roots. Environ. Microbiol., October 2000, roč. 2, čís. 5, s. 495–505. PMID 11233158.
- ↑ Prangishvili D., Forterre P., Garrett R. A.. Viruses of the Archaea: a unifying view. Nat. Rev. Microbiol., 2006, roč. 4, čís. 11, s. 837–48. DOI:10.1038/nrmicro1527. PMID 17041631.
- ↑ Prangishvili D., Garrett R. A.. Exceptionally diverse morphotypes and genomes of crenarchaeal hyperthermophilic viruses. Biochem. Soc. Trans., 2004, roč. 32, čís. Pt 2, s. 204–8. Dostupné online. DOI:10.1042/BST0320204. PMID 15046572.
- ↑ Mojica F. J., Díez-Villaseñor C., García-Martínez J., Soria E.. Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements. J. Mol. Evol., 2005, roč. 60, čís. 2, s. 174–82. DOI:10.1007/s00239-004-0046-3. PMID 15791728.
- ↑ Makarova K. S., Grishin N. V., Shabalina S. A., Wolf Y. I., Koonin E. V.. A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action. Biol. Direct, 2006, roč. 1, s. 7. DOI:10.1186/1745-6150-1-7. PMID 16545108.
- ↑ Breithaupt H.. The hunt for living gold. The search for organisms in extreme environments yields useful enzymes for industry. EMBO Rep., 2001, roč. 2, čís. 11, s. 968–71. DOI:10.1093/embo-reports/kve238. PMID 11713183.
- ↑ 120,0 120,1 Egorova K., Antranikian G.. Industrial relevance of thermophilic Archaea. Curr. Opin. Microbiol., 2005, roč. 8, čís. 6, s. 649–55. PMID 16257257.
- ↑ Synowiecki J., Grzybowska B., Zdziebło A.. Sources, properties and suitability of new thermostable enzymes in food processing. Crit Rev Food Sci Nutr, 2006, roč. 46, čís. 3, s. 197–205. DOI:10.1080/10408690590957296. PMID 16527752.
- ↑ Schiraldi C., Giuliano M., De Rosa M.. Perspectives on biotechnological applications of archaea. Archaea, 2002, roč. 1, čís. 2, s. 75–86. Dostupné online. PMID 15803645.
- ↑ Norris P. R., Burton N. P., Foulis N. A.. Acidophiles in bioreactor mineral processing. Extremophiles, 2000, roč. 4, čís. 2, s. 71–6. DOI:10.1007/s007920050139. PMID 10805560.
- ↑ O'Connor E. M., Shand R. F.. Halocins and sulfolobicins: the emerging story of archaeal protein and peptide antibiotics. J. Ind. Microbiol. Biotechnol., January 2002, roč. 28, čís. 1, s. 23–31. DOI:10.1038/sj/jim/7000190. PMID 11938468.
- ↑ Blum P. (ed.). Archaea: New Models for Prokaryotic Biology. [s.l.] : Caister Academic Press, 2008. ISBN 978-1-904455-27-1. Kapitola Archaeal Antimicrobials: An Undiscovered Country.
Literatura
- KLABAN, Vladimír. Ilustrovaný mikrobiologický slovník. 1. vyd. Praha : Galén, 2005. ISBN 80-7262-341-9. S. 654.
- KLABAN, Vladimír. Svět mikrobů: ilustrovaný lexikon mikrobiologie životního prostředí. 2. vyd. Hradec Králové : Gaudeamus, 2001. ISBN 80-7041-687-4. S. 416.
- STORCHOVÁ, Zuzana. Mikrosvět, stále se objevují noví zástupci mikrobiální říše. Vesmír, listopad 1997, roč. 76.
- HOWLAND, John L.. The Surprising Archaea: Discovering Another Domain of Life. Oxford : Oxford University Press, 2000. ISBN 0-19-511183-4. (anglicky)
- MARTINKO, J. M.; MADIGAN, MT. Brock Biology of Microorganisms. 11th ed.. vyd. Englewood Cliffs, N.J : Prentice Hall, 2005. ISBN 0-13-144329-1. (anglicky)
- GARRETT, R. A.; KLENK, H.. Archaea: Evolution, Physiology and Molecular Biology. [s.l.] : WileyBlackwell, 2005. ISBN 1-40-514404-1. (anglicky)
- CAVICCHIOLI, R. Archaea: Molecular and Cellular Biology. [s.l.] : American Society for Microbiology, 2007. ISBN 1-55-581391-7. (anglicky)
- BLUM, P. (editor). Archaea: New Models for Prokaryotic Biology. [s.l.] : Caister Academic Press, 2008. ISBN 978-1-904455-27-1. (anglicky)
- LIPPS, G. Plasmids: Current Research and Future Trends. [s.l.] : Caister Academic Press, 2008. ISBN 978-1-904455-35-6. Kapitola Archaeal Plasmids. (anglicky)
Externí odkazy
- Terminologické poznámky ke skupině Archaea (skloňování atp.)
- Zánět dásní vyvolávají archebakterie, článek na Osel.cz
- Organismy žijící v extrémních podmínkách - ARCHAEA, článek na IAN
- (anglicky) Úvod k archeím, univerzita Berkeley
- (anglicky) Rozcestník zajímavých anglických stránek o archeích
- (anglicky) Archea v oceánech - E.F. DeLong, ASM News, 2003
- (anglicky) Klasifikace archeí na stránce NCBI
- (anglicky) Strom života znázorňující příbuznost archeí s ostatními organismy
- (anglicky) Genomy archeí volně k dispozici
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |


