Multimediaexpo.cz je již 18 let na českém internetu !!
Oxidační číslo
Z Multimediaexpo.cz
Oxidační číslo (nebo také oxidační stav či stupeň) definuje součet pozitivních a negativních nábojů v atomu. Nepřímo udává počet přijatých, nebo odevzdaných elektronů. Smysl toto číslo má jen v případě, že se atom účastní iontové polární vazby. Pokud elektrony příjímá, je toto číslo záporné a pak se jedná o anion, pokud je odevzdává, je číslo kladné a jde o kation. Atom v základní stavu má oxidační číslo rovné nule. Atom jednoho prvku může mít různá oxidační čísla podle toho, v jaké sloučenině se zrovna nachází. Existují však přehledy důležitých oxidačních čísel. Definice oxidačního čísla podle IUPAC:[1]
"Oxidační číslo: Udává stupeň oxidace atomu ve sloučenině. Je definováno jako náboj, který by atom měl, pokud bychom mu přisoudili elektrony podle následujících pravidel: (1) oxidační stav volných (nevázaných) prvků je roven nule; (2) jednoduché (jednoatomové) ionty mají oxidační číslo rovno náboji; (3) v běžných sloučeninách má vodík oxidační číslo +1 a kyslík -2. (Výjimku z tohoto pravidla tvoří pro vodík hydridy, kde je oxidační číslo vodíku -1, výjimkou pro kyslík jsou peroxidy, kde dosahuje oxidačního čísla -1); (4) algebraický součet oxidačních čísel v neutrální molekule musí být roven nule, v případě iontu se musí součet rovnat náboji iontu. Například, oxidační čísla síry ve sloučeninách H2S, S8, SO2, SO3 a H2SO4 jsou: -2, 0, +4, +6 a +6. Čím je oxidační číslo atomu ve sloučenině vyšší, tím je vyšší i stupeň oxidace daného atomu. Naopak, čím je oxidační číslo nižší, tím je vyšší stupeň redukce."
Obsah |
Výpočet formálního oxidačního stavu
Existují dvě běžně používané metody pro výpočet oxidačního stavu atomu ve sloučenině. První se využívá u sloučenin, které mají Lewisovskou strukturu, jako např. organické molekuly. Druhá je použitelná pro jednoduché sloučeniny. Je důležité si uvědomit, že oxidační číslo atomu neodpovídá jeho reálnému náboji. Tyto dvě veličiny si odpovídají pouze u vysokých oxidačních čísel, kde je ionizační energie mnohem vyšší než energie chemických reakcí. Přiřazování vazebných elektronů jednotlivým atomům pomocí oxidačního čísla je čistě formální, ale je to velmi užitečné pro pochopení mnoha chemických reakcí.
Výpočet z Lewisovské struktury
Pokud známe Lewisovskou strukturu molekuly, můžeme jednoznačně určit oxidační stav atomů jako rozdíl mezi počtem valenčních elektronů neutrálního atomu a počtem elektronů, které atomu "patří" ve vázaném stavu. Pro výpočet oxidačního stavu uvažujeme, že elektrony z vazby mezi dvěma různými prvky patří elektronegativnějšímu atomu a elektrony z vazby mezi stejnými atomy se dělí rovným dílem.
Například kyselina octová:
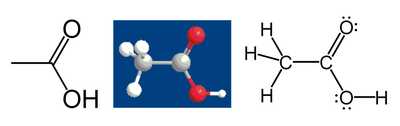 Uhlík z methylové skupiny má šest valenčních elektronů z vazeb k atomům vodíku, protože je více elektronegativní. Další elektron získá z vazby k atomu uhlíku karboxylové skupiny. Celkem mu tedy náleží sedm elektronů. Neutrální atom uhlíku má čtyři elektrony. Rozdíl, 4 - 7 = -3, je oxidační číslo atomu uhlíku.
Uhlík z methylové skupiny má šest valenčních elektronů z vazeb k atomům vodíku, protože je více elektronegativní. Další elektron získá z vazby k atomu uhlíku karboxylové skupiny. Celkem mu tedy náleží sedm elektronů. Neutrální atom uhlíku má čtyři elektrony. Rozdíl, 4 - 7 = -3, je oxidační číslo atomu uhlíku.
Výpočet bez využití Lewisovské struktury
Algebraický součet oxidačních čísel atomů v neutrální molekule musí být roven nule, v případě iontu se musí rovnat jeho náboji. Tento fakt spolu se skutečností, že některé prvky mají téměř vždy určitá oxidační čísla, umožňuje určit oxidační stav prvků v jednoduchých molekulách.
- Fluor má vždy oxidační číslo -1, protože je to nejelektronegativnější prvek.
- Vodík má běžně oxidační číslo +1, s výjimkou sloučenin, kde je vázán k elektropozitivnějšímu prvku (NaH, NaBH4, ...), kde má potom oxidační číslo -1.
- Kyslík má oxidační číslo -2, výjimku tvoří peroxidy (-1), superoxidy (-1/2), ozonidy (-1/3), difluorid kyslíku OF2 (+2) a difluorid dikyslíku O2F2 (+1).
- Alkalické kovy mají oxidační stav +1, výjimku tvoří pouze alkalidy.
- Kovy alkalických zemin mají vždy oxidační číslo +2.
- Halogeny, mají oxidační číslo -1, pokud nejsou vázány ke kyslíku, dusíku nebo jinému halogenu.
Příklad: V molekule Cr(OH)3, má kyslík oxidační číslo -2 a vodík +1. Tři hydroxidové skupiny mají tedy náboj -3. Jelikož se jedná o neutrální molekulu musí být oxidační stav chromu +3.
Přípony podle oxidačního čísla [2]
V názvech anorganických sloučenin se oxidační číslo významného prvku zohledňuje příponou. Například v chloridu železitém má atom železa oxidační číslo 3 (-itý).
| oxidační číslo | přípona | příklad |
|---|---|---|
| +I | -ný | chlorid sodný |
| +II | -natý | sulfid olovnatý |
| +III | -itý | oxid hlinitý, kyselina boritá |
| +IV | -ičitý | kyselina křemičitá, oxid dusičitý |
| +V | -ičný, -ečný | kyselina jodičná, oxid vanadičný, oxid fosforečný |
| +VI | -ový | fluorid sírový |
| +VII | -istý | kyselina chloristá |
| +VIII | -ičelý | oxid osmičelý |
Reference
- ↑ IUPAC Gold Book
- ↑ Petr Slavíček, Jan Kotek; Chemické listy; ročník 104 (4); rok 2010; str. 286-288
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |
