Dusičnan amonný
Z Multimediaexpo.cz
m (1 revizi) |
(+ Trojice "doktorů" z Afriky před obrovskou hromadou pytlů s ledkem amonným (Nitroprill HD) v Bejrútu (4.8. 2020)…) |
||
| Řádka 1: | Řádka 1: | ||
{{Infobox Chemická sloučenina | {{Infobox Chemická sloučenina | ||
|Název=Dusičnan amonný | |Název=Dusičnan amonný | ||
| - | |Obrázek= | + | |Obrázek=[[Soubor:Ammonium-nitrate-xtal-3D-balls-A.png|200px|3D schéma molekuly NH<sub>4</sub>NO<sub>3</sub>]]<br /> |
| - | [[Soubor:Ammonium-nitrate-xtal-3D-balls-A.png|200px|3D schéma molekuly NH<sub>4</sub>NO<sub>3</sub>]]<br /> | + | |
[[Soubor:Dusičnan amonný.PNG|200px|Dusičnan amonný]] | [[Soubor:Dusičnan amonný.PNG|200px|Dusičnan amonný]] | ||
|Systematický název=Dusičnan amonný | |Systematický název=Dusičnan amonný | ||
| Řádka 20: | Řádka 19: | ||
|S-věty={{S15}},{{S16}},{{S26}},{{S36}} | |S-věty={{S15}},{{S16}},{{S26}},{{S36}} | ||
|NFPA 704={{NFPA 704|Zdraví=2|Hořlavost=0|Reaktivita=3|Ostatní rizika=OX}} | |NFPA 704={{NFPA 704|Zdraví=2|Hořlavost=0|Reaktivita=3|Ostatní rizika=OX}} | ||
| - | }} | + | }}[[Soubor:Ammonium-nitrate-2D.png|thumb|240px|2D model molekuly NH<sub>4</sub>NO<sub>3</sub>]] |
| - | '''Dusičnan amonný''', triviálním názvem '''ledek amonný''' či '''amoniumnitrát''', je [[chemická sloučenina]] ([[dusičnan]] [[amoniak]]u) s [[chemický vzorec|chemickým vzorcem]] NH<sub>4</sub>NO<sub>3</sub>. | + | [[Soubor:Ammonium Nitrate.jpg|thumb|240px|Vzorek dusičnanu amonného]] |
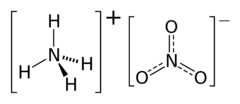
| - | + | '''Dusičnan amonný''', triviálním názvem '''ledek amonný''' či '''amoniumnitrát''', je [[chemická sloučenina]] ([[Dusičnany|dusičnan]] [[amoniak]]u) s [[chemický vzorec|chemickým vzorcem]] NH<sub>4</sub>NO<sub>3</sub>. | |
| - | + | ||
| + | Je to bílá [[krystal]]ická látka používaná jako [[Hnojivo|zemědělské hnojivo]] a díky [[oxidační činidlo|oxidačním vlastnostem]] také v [[Pyrotechnika|pyrotechnice]]. | ||
| + | == Bezpečnost == | ||
| + | Dusičnan amonný se při zahřátí bezvýbušně rozkládá na [[oxid dusný]] („rajský plyn“) a [[Vodní pára|vodní páru]]: | ||
| + | |||
| + | :NH<sub>4</sub>NO<sub>3</sub> → N<sub>2</sub>O + 2 H<sub>2</sub>O | ||
| + | Jestliže však dojde k [[Detonace|detonaci]], je tento rozklad doprovázen [[Výbuch|výbuchem]]. Velké zásoby této látky mohou být také požárním rizikem, protože podporuje hoření, což může snadno vést až právě k detonaci. Výbuchy dusičnanu amonného nejsou vzácným jevem, k méně závažným případům dochází téměř každoročně. Zaznamenáno však bylo i několik rozsáhlých, zničujících výbuchů, k nimž se řadí: | ||
| + | |||
| + | * [[Exploze chemičky v Oppau]] (dnes součást města [[Ludwigshafen]]) v [[Německo|Německu]] 21. září 1921 (jeden z nejničivějších vyvolaných nenukleárních výbuchů v dějinách) | ||
| + | * [[Neštěstí v Texas City]] (přístav v [[Mexický záliv|Mexickém zálivu]]) v [[Spojené státy americké|USA]] 16. dubna 1947 | ||
| + | * Exploze chemičky AZF v Toulouse, Francie 21.září 2001<ref>{{Citace elektronického periodika | ||
| + | | titul = Ve Francii začíná soudní proces století | ||
| + | | periodikum = Česká televize | ||
| + | | datum_vydání = 23. února 2009 | ||
| + | | url = https://ct24.ceskatelevize.cz/svet/1419752-ve-francii-zacina-soudni-proces-stoleti | ||
| + | }}</ref> | ||
| + | * [[Exploze v továrně na hnojiva ve Westu|Exploze v továrně Adair Grain]], [[West (Texas)|West]] (TX), USA, 17.dubna 2013 <ref>{{Citace elektronického periodika | ||
| + | | titul = Příčina výbuchu ledek. Bejrút není první podobný případ | ||
| + | | periodikum = Seznam Zprávy | ||
| + | | datum_vydání = 6. srpna 2020 | ||
| + | | url = https://www.seznamzpravy.cz/clanek/pricina-vybuchu-ledek-bejrut-neni-prvni-podobny-pripad-114970 | ||
| + | }}</ref> | ||
| + | [[Soubor:Doktori z Afriky se rozhodli masivne obohatit cely pristav v Bejrutu-2020.png|thumb|240px|Trojice "doktorů" z Afriky před obrovskou hromadou pytlů s ledkem amonným (Nitroprill HD) v [[Bejrút|Bejrútu]] (4.8. 2020)…]] | ||
| + | * [[Exploze v Tchien-ťinu v srpnu 2015|Exploze v Tchien-ťinu]] (přístav ve [[Žluté moře|Žlutém moři]]) v [[Čínská lidová republika|Číně]] 12. srpna 2015 | ||
| + | * [[Výbuch v bejrútském přístavu 2020|Výbuch v přístavu]] v [[Bejrút|Bejrútu]] ([[Středozemní moře]]) v [[Libanon|Libanonu]] 4. srpna 2020 <ref>{{Citace elektronického periodika | ||
| + | | titul = Výbuch v Bejrútu: Lidé hledají blízké, na místo míří zahraniční pomoc - Seznam Zprávy | ||
| + | | periodikum = www.seznamzpravy.cz | ||
| + | | url = https://www.seznamzpravy.cz/clanek/exploze-v-bejrutu-nejmene-deset-mrtvych-a-stovky-zranenych-114760 | ||
| + | | datum přístupu = 2020-08-05 | ||
| + | }}</ref> | ||
| + | |||
| + | S ohledem na svou výbušnost je dusičnan amonný uveden v [[Seznam látek považovaných za prekurzory výbušnin|seznamu látek]] považovaných za [[Prekurzor (chemie)|prekurzory]] [[Výbušnina|výbušnin]], jejichž prodej nepodnikajícím [[Fyzická osoba|fyzickým osobám]] podléhá v [[Evropská unie|Evropské unii]] dozoru, aby bylo zabráněno jejich zneužití k nedovolené výrobě výbušnin.<ref>{{Citace elektronického periodika | ||
| + | | příjmení = | ||
| + | | jméno = | ||
| + | | titul = Nařízení Evropského parlamentu a Rady (EU) 2019/1148 ze dne 20. června 2019 o uvádění prekurzorů výbušnin na trh a o jejich používání, změně nařízení (ES) č. 1907/2006 a zrušení nařízení (EU) č. 98/2013 | ||
| + | | periodikum = EUR-Lex | ||
| + | | vydavatel = | ||
| + | | url = https://eur-lex.europa.eu/legal-content/CS/TXT/?uri=CELLAR:49d1a404-a3b3-11e9-9d01-01aa75ed71a1 | ||
| + | | datum vydání = | ||
| + | | jazyk = cs | ||
| + | | url archivu = | ||
| + | | datum přístupu = 2020-08-04 | ||
| + | }}</ref> Dusičnan amonný nelze podle tohoto nařízení prodávat ani držet samostatně ani ve směsích či látkách, v nichž je koncentrace dusíku pocházejícího z dusičnanu amonného větší nebo rovna 16 [[Hmotnostní koncentrace|% hmotnostním]]. | ||
| + | |||
== Příprava == | == Příprava == | ||
| - | Dusičnan amonný se připravuje reakcí [[kyselina dusičná|kyseliny dusičné]] a [[ | + | Dusičnan amonný může vznikat přeměnou [[močovina|močoviny]]: |
| - | :HNO<sub>3</sub> + NH<sub>3</sub> → NH<sub>4</sub>NO<sub>3</sub> | + | :3CO(NH<sub>2</sub>)<sub>2</sub> + 2 [[voda|H<sub>2</sub>O]] → NH<sub>4</sub>NO<sub>3</sub> + 3 [[methan|CH<sub>4</sub>]] + 2 [[Dusík|N<sub>2</sub>]] |
| + | Obvykle se však připravuje reakcí [[kyselina dusičná|kyseliny dusičné]] a [[Amoniak|čpavku]]:<ref>[http://www.google.com/patents/pdf/Process_of_producing_concentrated_soluti.pdf?id=XronAAAAEBAJ&output=pdf&sig=ACfU3U0iYFRDUxltKLaVind-3wwP_JYPxg Process_of_producing_concentrated_soluti]</ref> | ||
| + | |||
| + | :HNO<sub>3</sub> + NH<sub>3</sub> → NH<sub>4</sub>NO<sub>3</sub> | ||
| + | |||
Dusičnan amonný se také vyrábí amatérskými nadšenci reakcí: | Dusičnan amonný se také vyrábí amatérskými nadšenci reakcí: | ||
| - | + | ||
:Ca(NO<sub>3</sub>)<sub>2</sub> + (NH<sub>4</sub>)<sub>2</sub>SO<sub>4</sub> → 2 NH<sub>4</sub>NO<sub>3</sub> + CaSO<sub>4</sub> | :Ca(NO<sub>3</sub>)<sub>2</sub> + (NH<sub>4</sub>)<sub>2</sub>SO<sub>4</sub> → 2 NH<sub>4</sub>NO<sub>3</sub> + CaSO<sub>4</sub> | ||
| - | Tato reakce je silně [[exotermní reakce|exotermní]]. | + | |
| + | Tato reakce je silně [[exotermní reakce|exotermní]]. Lze ho také připravit reakcí [[Dusičnan stříbrný|AgNO<sub>3(aq)</sub>]] s NH<sub>4</sub>Cl<sub>(aq)</sub>, přičemž vzniká jako [[rozpustnost|nerozpustná]] sůl [[chlorid stříbrný|AgCl]], která se dá odfiltrovat, takže výtěžek je pak poměrně vysoký. | ||
| + | |||
== Využití == | == Využití == | ||
* V [[zemědělství]] jako [[hnojivo]] | * V [[zemědělství]] jako [[hnojivo]] | ||
| - | |||
* V [[pyrotechnika|pyrotechnice]] | * V [[pyrotechnika|pyrotechnice]] | ||
| + | * Složka explosivní náplně některých bomb, např. [[BLU-82]] | ||
== Reference == | == Reference == | ||
<references /> | <references /> | ||
| + | |||
| + | == Literatura == | ||
| + | * {{Citace monografie|příjmení = VOHLÍDAL|jméno = JIŘÍ|příjmení2 = ŠTULÍK|jméno2 = KAREL|příjmení3 = JULÁK|jméno3 = ALOIS|rok = 1999|titul = Chemické a analytické tabulky|vydavatel = Grada Publishing|místo = Praha|isbn = 80-7169-855-5|vydání = 1}} | ||
| - | {{Článek z Wikipedie}} | + | {{Flickr|Ammonium+nitrate}}{{Commonscat|Ammonium nitrate}}{{Článek z Wikipedie}} |
[[Kategorie:Amonné sloučeniny]] | [[Kategorie:Amonné sloučeniny]] | ||
[[Kategorie:Dusičnany]] | [[Kategorie:Dusičnany]] | ||
[[Kategorie:Pyrotechnika]] | [[Kategorie:Pyrotechnika]] | ||
Aktuální verze z 6. 8. 2020, 14:12
Dusičnan amonný, triviálním názvem ledek amonný či amoniumnitrát, je chemická sloučenina (dusičnan amoniaku) s chemickým vzorcem NH4NO3.
Je to bílá krystalická látka používaná jako zemědělské hnojivo a díky oxidačním vlastnostem také v pyrotechnice.
Obsah |
Bezpečnost
Dusičnan amonný se při zahřátí bezvýbušně rozkládá na oxid dusný („rajský plyn“) a vodní páru:
- NH4NO3 → N2O + 2 H2O
Jestliže však dojde k detonaci, je tento rozklad doprovázen výbuchem. Velké zásoby této látky mohou být také požárním rizikem, protože podporuje hoření, což může snadno vést až právě k detonaci. Výbuchy dusičnanu amonného nejsou vzácným jevem, k méně závažným případům dochází téměř každoročně. Zaznamenáno však bylo i několik rozsáhlých, zničujících výbuchů, k nimž se řadí:
- Exploze chemičky v Oppau (dnes součást města Ludwigshafen) v Německu 21. září 1921 (jeden z nejničivějších vyvolaných nenukleárních výbuchů v dějinách)
- Neštěstí v Texas City (přístav v Mexickém zálivu) v USA 16. dubna 1947
- Exploze chemičky AZF v Toulouse, Francie 21.září 2001[1]
- Exploze v továrně Adair Grain, West (TX), USA, 17.dubna 2013 [2]

- Exploze v Tchien-ťinu (přístav ve Žlutém moři) v Číně 12. srpna 2015
- Výbuch v přístavu v Bejrútu (Středozemní moře) v Libanonu 4. srpna 2020 [3]
S ohledem na svou výbušnost je dusičnan amonný uveden v seznamu látek považovaných za prekurzory výbušnin, jejichž prodej nepodnikajícím fyzickým osobám podléhá v Evropské unii dozoru, aby bylo zabráněno jejich zneužití k nedovolené výrobě výbušnin.[4] Dusičnan amonný nelze podle tohoto nařízení prodávat ani držet samostatně ani ve směsích či látkách, v nichž je koncentrace dusíku pocházejícího z dusičnanu amonného větší nebo rovna 16 % hmotnostním.
Příprava
Dusičnan amonný může vznikat přeměnou močoviny:
Obvykle se však připravuje reakcí kyseliny dusičné a čpavku:[5]
- HNO3 + NH3 → NH4NO3
Dusičnan amonný se také vyrábí amatérskými nadšenci reakcí:
- Ca(NO3)2 + (NH4)2SO4 → 2 NH4NO3 + CaSO4
Tato reakce je silně exotermní. Lze ho také připravit reakcí AgNO3(aq) s NH4Cl(aq), přičemž vzniká jako nerozpustná sůl AgCl, která se dá odfiltrovat, takže výtěžek je pak poměrně vysoký.
Využití
- V zemědělství jako hnojivo
- V pyrotechnice
- Složka explosivní náplně některých bomb, např. BLU-82
Reference
- ↑ Ve Francii začíná soudní proces století. Česká televize [online]. . Dostupné online.
- ↑ Příčina výbuchu ledek. Bejrút není první podobný případ. Seznam Zprávy [online]. . Dostupné online.
- ↑ Výbuch v Bejrútu: Lidé hledají blízké, na místo míří zahraniční pomoc - Seznam Zprávy. www.seznamzpravy.cz [online]. [cit. 2020-08-05]. Dostupné online.
- ↑ Nařízení Evropského parlamentu a Rady (EU) 2019/1148 ze dne 20. června 2019 o uvádění prekurzorů výbušnin na trh a o jejich používání, změně nařízení (ES) č. 1907/2006 a zrušení nařízení (EU) č. 98/2013. EUR-Lex [online]. [cit. 2020-08-04]. Dostupné online. ( )
- ↑ Process_of_producing_concentrated_soluti
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |